Topamax 25mg Janssen, Hộp 6 vỉ x 10 viên
- Đơn trị liệu hoặc hỗ trợ cơn động kinh khởi phát cục bộ hoặc cơn động kinh toàn thể có hoặc không co cứng-co giật
- Điều trị hỗ trợ động kinh có kèm hội chứng Lennox Gastaut.
- Điều trị phòng ngừa migraine.
- Nhập Khẩu
- Ký Gửi
Thông tin khuyến mãi
- Đăng ký tài khoản Doanh nghiệp (Quầy thuốc, Nhà Thuốc, Phòng khám, Doanh Nghiệp) Hướng dẫn đăng ký xem giá sỉ
- Tìm hiểu các loại bệnh phổ biến Tìm hiểu bệnh
- Tìm hiểu thông tin các Hoạt chất thông dụng
 Giao hàng toàn quốc: Viettel Post, VNPost, GHN, GHTK
Giao hàng toàn quốc: Viettel Post, VNPost, GHN, GHTK
![]() Giao hàng nhanh tại Tp HCM
Giao hàng nhanh tại Tp HCM
![]() Đổi trả miễn phí trong vòng 7 ngày
Đổi trả miễn phí trong vòng 7 ngày
![]() Hotline: 028.6686.3399
Hotline: 028.6686.3399
Bán lẻ: 0909 546 070
Bán sỉ: 0901 346 379
| Quy cách đóng gói | 60 viên |
| Thương hiệu | JANSSEN - CILAG S.P.A |
| Xuất xứ | Bỉ |
Thành phần
Viên nén bao phim.
- Viên nén được khắc, chạm hoặc dập nổi.
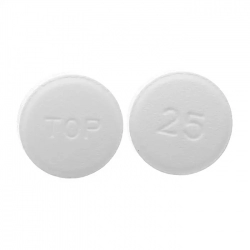
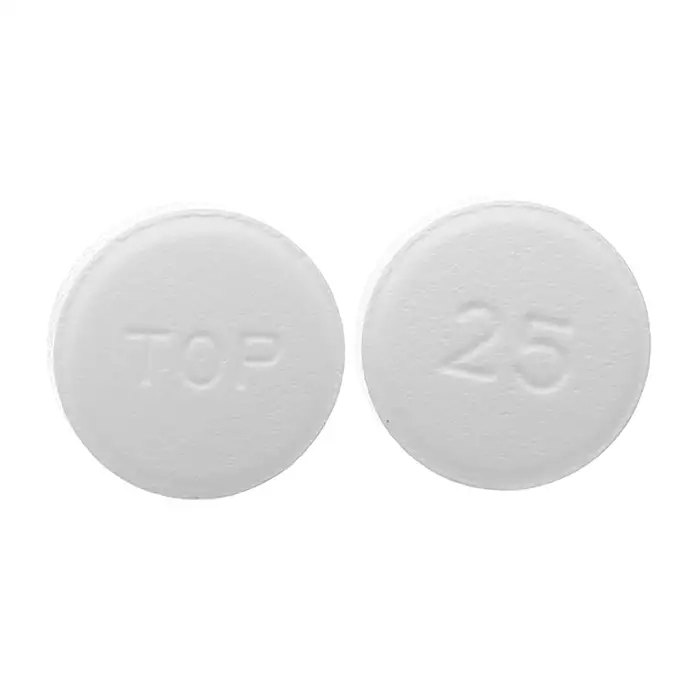
- Viên nén 25mg: viên nén tròn, màu trắng, có chữ “TOP” trên một mặt; mặt còn lại có số “25”. Mỗi viên nén có chứa 25mg Topiramat.
Tá dược
- Nhân viên: lactose monohydrat, magnesi stearat, cellulose vi tinh thể, tinh bột tiền gelatin hoá, tinh bột natri glycolat.
- Vỏ bao phim: sáp Carnauba, OPADRY trắng, vàng, hồng có chứa các thành phần sau: hypromellose, polyethylen glycol, polysorbat, oxyd sắt tổng hợp (chỉ với lớp bao màu vàng và hồng), titan dioxid.
Công dụng (Chỉ định)
- Đơn trị liệu cho người lớn và trẻ em trên 6 tuổi trong điều trị động kinh cục bộ có kèm hoặc không kèm động kinh toàn thể thứ phát, và cơn động kinh co cứng - co giật toàn thể nguyên phát.
- Phối hợp trong điều trị cho người lớn và trẻ em từ 2 tuổi trở lên bị cơn động kinh khởi phát cục bộ, có kèm hoặc không kèm động kinh toàn thể thứ phát hoặc cơn động kinh co cứng - co giật toàn thể nguyên phát và trong điều trị cơn động kinh liên quan đến hội chứng Lennox-Gastaut.
- TOPAMAX được chỉ định điều trị dự phòng đau nửa đầu ở người lớn sau khi đánh giá kỹ lưỡng các biện pháp điều trị khác. Topiramat không dùng để điều trị cơn đau nửa đầu cấp.
Liều dùng
Không cần thiết phải kiểm soát nồng độ topiramat trong huyết tương để tối ưu hóa điều trị với TOPAMAX. Trong những trường hợp hiếm, sử dụng thêm TOPAMAX với phenytoin có thể cần điều chỉnh liều phenytoin để đạt được hiệu quả lâm sàng tối ưu. Có thể cần điều chỉnh liều TOPAMAX nếu thêm vào hoặc ngừng phenytoin và carbamazepin trong điều trị phối hợp với TOPAMAX.
Liều lượng
- Nên khởi đầu liều thấp và chỉnh liều sau đó để đạt được mức liều có hiệu quả.
Động kinh - điều trị phối hợp
Người lớn
- Nên khởi đầu với liều 25 tới 50mg vào mỗi buổi tối trong một tuần. Đã có báo việc sử dụng liều khởi đầu thấp hơn nhưng chưa được nghiên cứu một cách hệ thống. Sau đó cách mỗi một tuần hoặc mỗi hai tuần, nên tăng liều thêm 25 tới 50mg/ngày và chia làm 2 lần uống mỗi ngày. Việc chỉnh liều phải dựa vào đáp ứng lâm sàng. Một số bệnh nhân có thể đạt hiệu quả điều trị khi dùng liều 1 lần/ngày.
- Trong các thử nghiệm lâm sàng khi điều trị phối hợp, mức liều 200mg là có hiệu quả và là liều thấp nhất được nghiên cứu. Vì vậy, liều này có thể được xem như là liều tối thiểu đạt hiệu quả. Liều dùng thông thường hàng ngày là 200 đến 400mg, chia làm hai lần. Một số bệnh nhân đã được dùng ở liều cao 1600mg/ngày.
- Các khuyến cáo về liều dùng này áp dụng cho tất cả người lớn, kể cả người cao tuổi hiện không có bệnh về thận (Xem Cảnh báo và Thận trọng - Suy thận).
Trẻ em từ 2 tuổi trở lên
- Tổng liều dùng hàng ngày của TOPAMAX khi điều trị phối hợp được khuyến cáo khoảng 5 đến 9mg/kg/ngày, chia làm hai lần. Việc chỉnh liều nên được khởi đầu bằng 25mg (hoặc thấp hơn, dựa trên phạm vi liều từ 1 đến 3mg/kg/ngày) vào mỗi tối trong tuần đầu tiên. Sau đó để đạt được đáp ứng lâm sàng tối ưu, sau cách mỗi 1 hoặc 2 tuần nên tăng liều trong giới hạn khoảng 1 đến 3mg/kg/ngày (chia làm hai lần uống). Việc chỉnh liều nên dựa trên đáp ứng lâm sàng.
- Liều dùng hàng ngày lên tới 30mg/kg/ngày đã được nghiên cứu và nói chung được dung nạp tốt.
Động kinh - Đơn trị liệu
- Khi ngừng các thuốc chống động kinh phối hợp để đạt được đơn trị liệu bằng topiramat, nên xem xét đến những tác động có thể có của việc này trên sự kiểm soát cơn động kinh. Liều của các thuốc chống động kinh điều trị phối hợp được khuyến cáo giảm từ từ với tỷ lệ khoảng 1/3 mỗi hai tuần trừ khi cần phải ngừng ngay các thuốc chống động kinh phối hợp vì liên quan đến tính an toàn (Xem Cảnh báo và Thận trọng - Ngưng thuốc TOPAMAX).
- Khi ngừng dùng các thuốc gây cảm ứng men, nồng độ của topiramat sẽ tăng.
- Có thể cần phải giảm liều TOPAMAX nếu có chỉ định lâm sàng.
Người lớn
- Sự chỉnh liều nên khởi đầu ở liều 25mg dùng mỗi buổi tối trong một tuần. Sau đó, cách mỗi 1 tuần hoặc mỗi hai tuần, nên tăng liều thêm 25 hoặc 50mg/ngày và chia làm 2 lần uống một ngày. Nếu bệnh nhân không thể dung nạp với chế độ chỉnh liều như vậy, thì nên tăng liều ít hơn hoặc kéo dài khoảng thời gian giữa các lần tăng liều. Liều và tốc độ chỉnh liều nên dựa trên đáp ứng lâm sàng.
- Liều khởi đầu khuyến cáo khi đơn trị liệu bằng topiramat ở người lớn trong khoảng 100 đến 200mg/ngày chia làm 2 lần và liều hàng ngày tối đa được khuyến cáo là 500mg/ngày chia làm 2 lần. Một số bệnh nhân động kinh thể kháng trị dung nạp với topiramat ở liều 1000mg/ngày trong đơn trị liệu. Các liều khuyến cao này áp dụng cho tất cả người lớn, kể cả người cao tuổi không có bệnh về thận.
Trẻ em từ 6 tuổi trở lên
- Trẻ em từ 6 tuổi trở lên nên bắt đầu với liều từ 0,5mg đến 1mg/kg vào buổi tối, trong tuần đầu. Sau đó cách mỗi 1 hoặc 2 tuần, tăng liều khoảng 0,5 đến 1mg/kg/ngày, chia làm hai lần uống. Nếu trẻ không thể dung nạp với chế độ chỉnh liều trên, thì nên tăng liều ít hơn hoặc kéo dài thời gian giữa các lần tăng liều. Liều và tốc độ chỉnh liều nên dựa trên đáp ứng lâm sàng.
- Liều khởi đầu khuyến cáo khi đơn trị liệu bằng topiramat ở trẻ em từ 6 tuổi trở lên là từ 100 đến 400mg/ngày. Trẻ em mới được chẩn đoán cơn động kinh khởi phát cục bộ đã dùng liều lên đến 500mg/ngày.
Đau nửa đầu:
Người lớn
- Tổng liều khuyên dùng mỗi ngày của topiramat trong điều trị dự phòng đau nửa đầu là 100mg/ngày, chia làm 2 lần. Sự chỉnh liều nên khởi đầu bằng liều 25mg dùng mỗi tối trong một tuần. Sau đó mỗi tuần nên tăng thêm 25mg/ngày. Nếu bệnh nhân không thể dung nạp với chế độ chỉnh liều như vậy thì nên kéo dài hơn khoảng thời gian giữa các lần điều chỉnh liều. Ở một số bệnh nhân đã có hiệu quả với tổng liều hằng ngày 50mg/ngày. Một số bệnh nhân đã sử dụng tổng liều hằng ngày lên đến 200mg/ngày. Liều và tốc độ chỉnh liều nên dựa trên đáp ứng lâm sàng. (Xem Đặc tính dược lực học - Các thử nghiệm lâm sàng đau nửa đầu).
Bệnh nhân đặc biệt
Suy thận
- Ở những bệnh nhân suy thận (độ thanh thải creatinin < 70 ml/phút), nên thận trọng khi uống topiramat bởi độ thanh thải của topiramat ở thận và huyết tương giảm. Bệnh nhân suy thận cần thời gian dài hơn để đạt tới trạng thái hằng định tại mỗi mức liều. Khuyến cáo giảm một nửa liều khởi đầu và liều duy trì (Xem Đặc tính dược động học), ở những bệnh nhân suy thận giai đoạn cuối, vì TOPAMAX bị loại khỏi hụyết tương khi chạy thận nhân tạo, nên bổ sung thêm nửa liều TOPAMAX thường dùng hằng ngày trong những ngày chạy thận. Liều TOPAMAX bổ sung khi chạy thận nên được chia ra dùng vào lúc bắt đầu và khi kết thúc quy trình chạy thận nhân tạo. Liều bổ sung có thể khác nhau dựa trên đặc tính thiết bị thẩm tách máu sử dụng (xem Đặc tính dược động học).
Suy gian
- Topiramat nên được dùng thận trọng ở bệnh nhân suy gan (Xem Đặc tính dược động học - Dân số đặc biệt, Suy gan).
Cách dùng
- TOPAMAX ở dạng viên nén dùng đường uống. Khuyến cáo khi dùng không được bẻ viên TOPAMAX.
- Có thể uống TOPAMAX mà không cần quan tâm đến bữa ăn.
Quá liều
Triệu chứng và dấu hiệu
- Quá liều topiramat đã được báo cáo. Dấu hiệu và triệu chứng bao gồm: co giật, buồn ngủ, rối loạn ngôn ngữ, nhìn mờ, nhìn đôi, sa sút tinh thần, lờ đờ, bất thường phối hợp, sững sờ, hạ huyết áp, đau bụng, kích động, choáng váng và trầm cảm. Hầu hết các trường hợp, tiến triển lâm sàng không trầm trọng ngoại trừ những trường hợp tử vong được báo cáo sau khi sử dụng quá liều nhiều thuốc có bao gồm topiramat. Quá liều topiramat có thể gây nên toan chuyển hóa nặng (Xem Cảnh báo và thận trọng - Toan chuyển hóa).
- Báo cáo quá liều topiramat cao nhất được tính vào khoảng 96g và 110g topiramat và dẫn đến hôn mê kéo dài 20 - 24 giờ, sau đó phục hồi hoàn toàn sau 3 đền 4 ngày.
Điều trị
- Trong trường hợp quá liều cấp, nếu bệnh nhân vừa mới uống vào, nên làm trống dạ dày ngay bằng cách rửa dạ dày hoặc gây nôn. Than hoạt tính có khả năng hấp thụ topiramat in vitro. Nên dùng các biện pháp hỗ trợ thích hợp. Lọc máu là phương cách hữu hiệu để loại topiramat ra khỏi cơ thể. Bệnh nhân nên được bù nước đầy đủ.
Không sử dụng trong trường hợp sau (Chống chỉ định)
- Quá mẫn cảm với bất cứ thành phần nào của thuốc.
- Dự phòng đau nửa đầu cho phụ nữ có thai và phụ nữ trong độ tuổi sinh sản không sử dụng các biện pháp tránh thai phù hợp.
Tác dụng không mong muốn (Tác dụng phụ)
Các phản ứng bất lợi được trình bày thông qua phần này. Các phản ứng bất lợi là các biến cố bất lợi đã được cân nhắc có sự liên quan hợp lý với việc sử dụng topiramat dựa trên đánh giá toàn diện các thông tin biến cố bất lợi có sẵn. Mối quan hệ nhân - quả của topiramat không thể được thiết lập một cách tin cậy với các trường hợp riêng rẽ. Hơn nữa, bởi vì các thử nghiệm lâm sàng được thực hiện dưới các điều kiện biến đổi rộng rãi, tỷ lệ các phản ứng bất lợi được quan sát thấy trong các thử nghiệm lâm sàng của thuốc không thể so sánh trực tiếp với tỷ lệ trong các thử nghiệm lâm sàng của thuốc khác và có thể không phản ánh các tỷ lệ quan sát được trong thực hành lâm sàng.
Dữ liệu thử nghiệm lâm sàng
- Tính an toàn của TOPAMAX đã được đánh giá qua các dữ liệu thử nghiệm lâm sàng gồm 4111 bệnh nhân (3182 dùng TOPAMAX và 929 dùng giả dược) từ 20 thử nghiệm mù đôi, và 2847 bệnh nhân từ 34 thử nghiệm nhãn mở, tương ứng, trong điều trị các cơn co cứng - co giật toàn thể nguyên phát, các cơn khởi phát cục bộ, các cơn co giật liên quan với hội chứng Lennox-Gastaut, các thể động kinh mới hoặc vừa mới được chẩn đoán, hoặc đau nửa đầu. Thông tin trình bày trong mục này được lấy từ dữ liệu chung. Đa số các phản ứng bất lợi là ở mức độ từ nhẹ cho tới trung bình.
Dữ liệu nghiên cứu mù đôi, có đối chứng với giả dược trong các thử nghiệm điều trị phối hợp bệnh động kinh - ở bệnh nhân người lớn
- Các phản ứng bất lợi của thuốc được báo cáo ≥ 1% trên bệnh nhân người lớn điều trị bằng TOPAMAX trong các thử nghiệm điều trị phối hợp bệnh động kinh kiểu mù đôi, có đối chứng với giả dược, được trình bày trong Bảng 1. Các phản ứng bất lợi của thuốc có tần suất > 5% ở phạm vi liều khuyến cáo (200 tới 400mg/ngày) trên người lớn trong các nghiên cứu điều trị phối hợp bệnh động kinh kiểu mù đôi, có đối chứng với giả dược, xếp theo thứ tự tần số giảm dần là: buồn ngủ, chóng mặt, mệt mỏi, kích thích, giảm cân, tâm thần chậm chạp, dị cảm, nhìn đôi, bất thường về phối hợp vận động, buồn nôn, rung giật nhãn cầu, lờ đờ, biếng ăn, rối loạn vận ngôn, nhìn mờ, giảm ngon miệng, suy giảm trí nhớ và tiêu chảy.
Bảng 1. Các phản ứng bất lợi được báo cáo với tần suất ≥ 1% của TOPAMAX ở bệnh nhân người lớn trong các nghiên cứu điều trị phối hợp bệnh động kinh kiểu mù đôi, có đối chứng với giả dược
|
Hệ thống/ Cơ quan Phản ứng bất lợi |
TOPAMAX 200 - 400mg/ngày (N = 354) % |
TOPAMAX 600 - 1000mg/ngày (N = 437) % |
GIẢ DƯỢC (N = 382) % |
| Rối loạn chuyển hóa và dinh dưỡng | |||
| Biếng ăn | 5,4 | 6,2 | 1,8 |
| Giảm ngon miệng | 5,1 | 8,7 | 3,7 |
| Rối loạn tâm thần | |||
| Tâm thần chậm chạp | 8,2 | 19,5 | 3,1 |
| Rối loạn về ngôn ngữ diễn đạt | 4,5 | 9,4 | 1,6 |
| Trạng thái lú lẫn | 3,1 | 5,0 | 0,8 |
| Trầm cảm | 3,1 | 11,7 | 3,4 |
| Mất ngủ | 3,1 | 6,4 | 4,5 |
| Gây hấn | 2,8 | 3,2 | 1,8 |
| Kích động | 1,7 | 2,3 | 1,3 |
| Giận dữ | 1,7 | 2,1 | 0,5 |
| Lo lắng | 1,7 | 6,6 | 2,9 |
| Mất định hướng | 1,7 | 3,2 | 1,0 |
| Thay đổi khí sắc | 1,7 | 4,6 | 1,0 |
| Rối loạn hệ thần kinh | |||
| Buồn ngủ | 17,8 | 17,4 | 8,4 |
| Chóng mặt | 16,4 | 34,1 | 13,6 |
| Dị cảm | 8,2 | 17,2 | 3,7 |
| Bất thường phối hợp | 7,1 | 11,4 | 4,2 |
| Rung giật nhãn cầu | 6,2 | 11,7 | 6,8 |
| Lờ đờ | 5,6 | 8,0 | 2,1 |
| Loạn vận ngôn | 5,4 | 6,2 | 1,0 |
| Giảm trí nhớ | 5,1 | 10,8 | 1,8 |
| Rối loạn chú ý | 4,5 | 11,9 | 1,8 |
| Run | 4,0 | 9,4 | 5,0 |
| Quên | 3,4 | 5,3 | 1,0 |
| Rối loạn thăng bằng | 3,4 | 3,9 | 2,4 |
| Giảm cảm giác | 3,1 | 5,9 | 1,0 |
| Run khi cử động có chủ ý | 3,1 | 4,8 | 2,9 |
| Loạn vị giác | 1,4 | 4,3 | 0,8 |
| Sa sút tâm thần | 1,4 | 5,0 | 1,3 |
| Rối loạn ngôn ngữ | 1,1 | 2,7 | 0,5 |
| Rối loạn mắt | |||
| Nhìn đôi | 7,3 | 12,1 | 5,0 |
| Nhìn mờ | 5,4 | 8,9 | 2,4 |
| Rối loạn thị giác | 2,0 | 1,4 | 0,3 |
| Rối loạn tiêu hóa | |||
| Buồn nôn | 6,8 | 15,1 | 8,4 |
| Tiêu chảy | 5,1 | 14,0 | 5,2 |
| Đau bụng trên | 3,7 | 3,9 | 2,1 |
| Táo bón | 3,7 | 3,2 | 1,8 |
| Khó chịu vùng dạ dày | 3,1 | 3,2 | 1,3 |
| Khó tiêu | 2,3 | 3,0 | 2,1 |
| Khô miệng | 1,7 | 3,7 | 0,3 |
| Đau bụng | 1,1 | 2,7 | 0,8 |
| Rối loạn hệ cơ xương và mô liên kết | |||
| Đau cơ | 2,0 | 2,5 | 1,3 |
| Co thắt cơ | 1,7 | 2,1 | 0,8 |
| Đau cơ xương vùng lồng ngực | 1,1 | 1,8 | 0,3 |
| Rối loạn toàn thân và tình trạng nơi dùng thuốc | |||
| Mệt mỏi | 13,0 | 30,7 | 11,8 |
| Kích thích | 9,3 | 14,6 | 3,7 |
| Suy nhược | 3,4 | 3,0 | 1,8 |
| Rối loạn dáng đi | 1,4 | 2,5 | 1,3 |
| Các chỉ số khác | |||
| Giảm cân | 9,0 | 11,9 | 4,2 |
Liều khuyến cáo trong điều trị phối hợp bệnh động kinh ở người lớn là 200 - 400mg/ngày
Dữ liệu nghiên cứu mù đôi, có đối chứng với giả dược trong các thử nghiệm điều trị phối hợp bệnh động kinh trên bệnh nhân nhi
- Các phản ứng bất lợi (ADR) được báo cáo > 2% ở trẻ từ 2 - 16 tuổi khi điều trị với TOPAMAX trong các thử nghiệm điều trị phối hợp bệnh động kinh mù đôi đối chứng giả dược được trình bày ở Bảng 2. Các phản ứng bất lợi có tần suất > 5% ở liều dùng khuyến cáo (5 - 9mg/kg/ngày) theo thứ tự tần suất giảm dần gồm giảm ngon miệng, mệt mỏi, buồn ngủ, lờ đờ, kích thích, rối loạn chú ý, giảm cân, gây hấn, phát ban, hành vi bất thường, biếng ăn, rối loạn thăng bằng và táo bón.
Bảng 2. Các phản ứng bất lợi của thuốc được báo cáo với tần suất ≥ 2% ở bệnh nhân nhi được điều trị phối hợp với TOPAMAX bệnh động kinh trong các nghiên cứu mù đôi đối chứng với giả dược
|
Hệ thống/ cơ quan Phản ứng bất lợi |
TOPAMAX (N = 104) % |
GIẢ DƯỢC (N = 102) % |
| Rối loạn chuyển hóa và dinh dưỡng | ||
| Giảm ngon miệng | 19,2 | 12,7 |
| Chán ăn | 5,8 | 1,0 |
| Rối loạn tâm thần | ||
| Gây hấn | 8,7 | 6,9 |
| Hành vi bất thường | 5,8 | 3,9 |
| Trạng thái lú lẫn | 2,9 | 2,0 |
| Thay đổi khí sắc | 2,9 | 2,0 |
| Rối loạn hệ thần kinh | ||
| Buồn ngủ | 15,4 | 6,9 |
| Lờ đờ | 13,5 | 8,8 |
| Rối loạn chú ý | 10,6 | 2,0 |
| Rối loạn thăng bằng | 5,8 | 2,0 |
| Chóng mặt | 4,8 | 2,9 |
| Giảm trí nhớ | 3,8 | 1,0 |
| Rối loạn hô hấp, lồng ngực và trung thất | ||
| Chảy máu mũi | 4,8 | 1,0 |
| Rối loạn hệ tiêu hóa | ||
| Táo bón | 5,8 | 4,9 |
| Rối loạn da và mô dưới da | ||
| Phát ban | 6,7 | 5,9 |
| Rối loạn toàn thân và tình trạng nơi dùng thuốc | ||
| Mệt mỏi | 16,3 | 4,9 |
| Kích thích | 11,5 | 8,8 |
| Rối loạn dáng đi | 4,8 | 2,0 |
| Các chỉ số khác | ||
| Giảm cân | 9,6 | 1,0 |
Liều khuyến cáo cho điều trị hỗ trợ bệnh động kinh ở trẻ em (2 - 16 tuổi) từ 5 - 9mg/kg/ngày
Dữ liệu nghiên cứu mù đôi, có đối chứng trong các thử nghiệm đơn trị động kinh - ở bệnh nhân người lớn
- Các phản ứng bất lợi được báo cáo với tần suất ≥ 1% ở bệnh nhân động kinh người lớn điều trị với TOPAMAX trong các thử nghiệm đơn trị động kinh mù đôi, có đối chứng được trình bày trong Bảng 3. Các phản ứng bất lợi có tần suất > 5% ở liều dùng khuyến cáo (400mg/ngày) theo thứ tự tần suất giảm dần gồm dị cảm, giảm cân, mệt mỏi, biếng ăn, trầm cảm, suy giảm trí nhớ, lo âu, tiêu chảy, suy nhược, loạn vị giác và giảm cảm giác.
Bảng 3. Phản ứng bất lợi được báo cáo ở ≥ 1% bệnh nhân người lớn điều trịTOPAMAX trong các nghiên cứu đơn trị động kinh mù đôi, có đối chứng.
|
Hệ thống/cơ quan Phản ứng bất lợi |
TOPAMAX 50mg/ngày (N = 257) % |
TOPAMAX 400mg/ngày (N = 153) % |
| Rối loạn máu và hệ lympho | ||
| Thiếu máu | 0,8 | 2,0 |
| Rối loạn chuyển hóa và dinh dưỡng | ||
| Chán ăn | 3,5 | 12,4 |
| Giảm ngon miệng | 2,3 | 2,6 |
| Rối loạn tâm thần | ||
| Trầm cảm | 4,3 | 8,5 |
| Lo âu | 3,9 | 6,5 |
| Tâm thần chậm chạp | 2,3 | 4,6 |
| Rối loạn ngôn ngữ diễn đạt | 3,5 | 4,6 |
| Khí sắc trầm cảm | 0,8 | 2,6 |
| Thay đổi khí sắc | 0,4 | 2,0 |
| Khí sắc hai chiều | 1,6 | 2,0 |
| Rối loạn hệ thần kinh | ||
| Dị cảm | 18,7 | 40,5 |
| Giảm trí nhớ | 1,2 | 7,2 |
| Loạn vị giác | 2,3 | 5,9 |
| Giảm cảm giác | 4,3 | 5,2 |
| Rối loạn thăng bằng | 1,6 | 3,3 |
| Rối loạn vận ngôn | 1,6 | 2,6 |
| Rối loạn nhận thức | 0,4 | 2,0 |
| Lờ đờ | 1,2 | 2,0 |
| Sa sút tâm thần | 0,8 | 2,0 |
| Giảm kỹ năng tâm thần vận động | 0 | 2,0 |
| An thần | 0 | 1,3 |
| Khiếm khuyết thị giác | 0,4 | 1,3 |
| Rối loạn mắt | ||
| Khô mắt | 0 | 1,3 |
| Rối loạn tai và tai trong | ||
| Đau tai | 0 | 1,3 |
| Ù tai | 1,6 | 1,3 |
| Rối loạn hô hấp, lồng ngực và trung thất | ||
| Khó thở | 1,2 | 2,0 |
| Sổ mũi | 0 | 1,3 |
| Rối loạn hệ tiêu hóa | ||
| Tiêu chảy | 5,4 | 6,5 |
| Dị cảm ở miệng | 1,2 | 3,3 |
| Khô miệng | 0,4 | 2,6 |
| Viêm dạ dày | 0,8 | 2,6 |
| Đau bụng | 1,2 | 2,0 |
| Bệnh trào ngược dạ dày thực quản | 0,4 | 2,0 |
| Chảy máu lợi | 0 | 1,3 |
| Rối loạn da và mô dưới da | ||
| Phát ban | 0,4 | 3,9 |
| Rụng tóc | 1,6 | 3,3 |
| Ngứa | 0,4 | 3,3 |
| Giảm cảm giác mặt | 0,4 | 2,0 |
| Ngứa toàn thân | 0 | 1,3 |
| Rối loạn hệ cơ xương khớp mô liên kết | ||
| Co cơ | 2,7 | 3.3 |
| Đau khớp | 1,9 | 2,0 |
| Co giật cơ | 0,4 | 1,3 |
| Rối loạn thận và hệ tiết niệu | ||
| Sỏi thận | 0 | 2,6 |
| Tiểu khó | 0,8 | 2,0 |
| Đái dắt | 0,8 | 2,0 |
| Rối loạn hệ sinh sản và vú | ||
| Rối loạn cương | 0,8 | 1,3 |
| Rối loạn toàn thân và tình trạng nơi dùng thuốc | ||
| Mệt mỏi | 15,2 | 14,4 |
| Suy nhược | 3,5 | 5,9 |
| Kích thích | 3,1 | 3,3 |
| Các chỉ số khác | ||
| Giảm cân | 7,0 | 17,0 |
Liều khuyến cáo cho đơn trị liệu ở người lớn là 400mg/ngày
Dữ liệu nghiên cứu mù đôi, có đối chứng trong các thử nghiệm đơn trị động kinh - ở bệnh nhân nhi
- Những phản ứng bất lợi báo cáo ở ≥ 2% bệnh nhi (10 - 16 tuổi) điều trị TOPAMAX trong các thử nghiệm đơn trị liệu bệnh động kinh mù đôi có đối chứng được đưa ra trong Bảng 4. Những phản ứng bất lợi có tỷ lệ > 5% ở liều khuyến cáo (400mg/ngày) với tần suất giảm dần bao gồm: giảm cân, dị cảm, tiêu chảy, rối loạn chú ý, sốt và rụng tóc.
Bảng 4. Những phản ứng bất lợi được báo cáo ở ≥ 2% bệnh nhi điều trị TOPAMAX trong các nghiên cứu đơn trị động kinh mù đôi có đối chứng
|
Hệ thống/Cơ quan Phản ứng bất lợi |
TOPAMAX 50mg/ngày (N = 77) % |
TOPAMAX 400mg/ngày (N = 63) % |
| Rối loạn chuyển hóa và dinh dưỡng | ||
| Giảm ngon miệng | 1,3 | 4,8 |
| Rối loạn tâm thần | ||
| Tâm thần chậm chạp | 0 | 4,8 |
| Thay đổi khí sắc | 1,3 | 4,8 |
| Trầm cảm | 0 | 3,2 |
| Rối loạn hệ thần kinh | ||
| Dị cảm | 3,9 | 15,9 |
| Rối loạn chú ý | 3,9 | 7,9 |
| Rối loạn tai và tai trong | ||
| Chóng mặt | 0 | 3,2 |
| Rối loạn hô hấp, lồng ngực và trung thất | ||
| Chảy máu mũi | 0 | 3,2 |
| Rối loạn hệ tiêu hóa | ||
| Tiêu chảy | 3,9 | 9,5 |
| Nôn | 3,9 | 4,8 |
| Rối loạn da và mô dưới da | ||
| Rụng tóc | 0 | 6,3 |
| Rối loạn toàn thân và tình trạng nơi dùng thuốc | ||
| Sốt | 0 | 6,3 |
| Suy nhược | 0 | 4,8 |
| Các chỉ số khác | ||
| Giảm cân | 7,8 | 20,6 |
| Hoàn cảnh xã hội | ||
| Mất khả năng học tập | 0 | 3,2 |
Liều khuyến cáo cho đơn trị liệu ở trẻ em từ 10 tuổi trở lên là 400mg/ngày
Dữ liệu mù đôi, có đối chúng giả dược trong các thử nghiệm dự phòng đau nửa đầu - ở bệnh nhân người lớn
- Phản ứng bất lợi được báo cáo ở ≥ 1% bệnh nhân người lớn điều trị TOPAMAX trong các thử nghiệm phòng ngừa đau nửa đầu mù đôi có đối chứng giả dược được đưa ra trong Bảng 5. Những phản ứng bất lợi có tần suất > 5% ở liều khuyến cáo (100mg/ngày) theo thứ tự tần suất giảm dần bao gồm: dị cảm, mệt mỏi, buồn nôn, tiêu chảy, giảm cân, loạn vị giác, chán ăn, giảm ngon miệng, mất ngủ, giảm cảm giác, rối loạn chú ý, lo âu, buồn ngủ và rối loạn ngôn ngữ diễn đạt.
Bảng 5. Phản ứng bất lợi được báo cáo ở ≥ 1% bệnh nhân người lớn điều trị TOPAMAX trong các thử nghiệm phòng ngừa đau nửa đầu mù đôi có đối chứng giả dược
|
Hệ thống/ Cơ quan Phản ứng bất lợi |
TOPAMAX 50mg/ngày (N=227) % |
TOPAMAX 100mg/ngày (N=374) % |
TOPAMAX 200mg/ngày (N=501) % |
GIẢ DƯỢC (N=436) % |
| Rối loạn chuyển hóa và dinh dưỡng | ||||
| Chán ăn | 3,5 | 7,5 | 7,2 | 3,0 |
| Giảm ngon miệng | 5,7 | 7,0 | 6,8 | 3,0 |
| Rối loạn tâm thần | ||||
| Mất ngủ | 4,8 | 7,0 | 5,6 | 3,9 |
| Lo âu | 4,0 | 5,3 | 5,0 | 1,8 |
| Rối loạn ngôn ngữ diễn đạt | 6,6 | 5,1 | 5,2 | 1,4 |
| Trầm cảm | 3,5 | 4,8 | 7,4 | 4,1 |
| Khí sắc trầm cảm | 0,4 | 2,9 | 2,0 | 0,9 |
| Trạng thái lú lẫn | 0,4 | 1,6 | 2,0 | 1,1 |
| Khí sắc 2 chiều | 1,8 | 1,3 | 1,0 | 0,2 |
| Cảm xúc không ổn định | 0,4 | 1,1 | 0,2 | 0,2 |
| Tâm thần chậm chạp | 1,8 | 1,1 | 3,4 | 1,4 |
| Rối loạn hệ thần kinh | ||||
| Dị cảm | 35,7 | 50,0 | 48,5 | 5,0 |
| Loạn vị giác | 15,4 | 8,0 | 12,6 | 0,9 |
| Giảm cảm giác | 5,3 | 6,7 | 7,4 | 1,4 |
| Rối loạn chú ý | 2,6 | 6,4 | 9,2 | 2,3 |
| Buồn ngủ | 6,2 | 5,1 | 6,8 | 3,0 |
| Giảm trí nhớ | 4,0 | 4,5 | 6,2 | 1,6 |
| Quên | 3,5 | 2,9 | 5,2 | 0,5 |
| Run | 1,3 | 1,9 | 2,4 | 1,4 |
| Rối loạn thăng bằng | 0,4 | 1,3 | 0,4 | 0 |
| Sa sút tâm thần | 0,4 | 1,1 | 1,8 | 0,9 |
| Rối loạn mắt | ||||
| Nhìn mờ | 4,0 | 2,4 | 4,4 | 2,5 |
| Rối loạn tai và tai trong | ||||
| Ù tai | 0,4 | 1,3 | 1,6 | 0,7 |
| Rối loạn hô hấp, lồng ngực và trung thất | ||||
| Khó thở | 1,3 | 2,7 | 1,6 | 1,4 |
| Chảy máu mũi | 0,4 | 1,1 | 0,6 | 0,5 |
| Rối loạn hệ tiêu hóa | ||||
| Buồn nôn | 9,3 | 13,6 | 14,6 | 8,3 |
| Tiêu chảy | 9,3 | 11,2 | 10,0 | 4,4 |
| Khô miệng | 1,8 | 3,2 | 5,0 | 2,5 |
| Dị cảm ở miệng | 1,3 | 2,9 | 1,6 | 0,5 |
| Táo bón | 1,8 | 2,1 | 1,8 | 1,4 |
| Chướng bụng | 0 | 1,3 | 0,2 | 0,2 |
| Khó chịu ở dạ dày | 2,2 | 1,3 | 1,0 | 0,2 |
| Trào ngược dạ dày thực quản | 0,4 | 1,1 | 1,2 | 0,5 |
| Rối loạn hệ cơ xương và mô liên kết | ||||
| Co giật cơ | 1,8 | 1,3 | 1,8 | 0,7 |
| Rối loạn toàn thân và tình trạng nơi dùng thuốc | ||||
| Mệt mỏi | 15,0 | 15,2 | 19,2 | 11,2 |
| Suy nhược | 0,9 | 2,1 | 2,6 | 0,5 |
| Kích thích | 3,1 | 1,9 | 2,4 | 0,9 |
| Khát | 1,3 | 1,6 | 1,0 | 0,5 |
| Các chỉ số khác | ||||
| Giảm cân | 5,3 | 9,1 | 10,8 | 1,4 |
Liều khuyến cáo trong phòng ngừa đau nửa đầu là 100mg/ngày.
Các dữ liệu thử nghiệm lâm sàng khác - bệnh nhân người lớn
- Các phản ứng bất lợi được báo cáo ở bệnh nhân người lớn điều trị TOPAMAX với tần suất < 1% trong các thử nghiệm mù đôi có đối chứng hoặc ở bất kỳ tần suất nào trong các nghiên cứu nhãn mở được trình bày ở Bảng 6.
| Bảng 6. Các phản ứng bất lợi được báo cáo ở bệnh nhân người lớn điều trị TOPAMAX với tần suất < 1% trong các nghiên cứu mù đôi có đối chứng hoặc bất kỳ tần suất nào trong nghiên cứu nhãn mở |
|
+ Rối loạn máu và hệ bạch huyết Giảm bạch cầu, bệnh hạch bạch huyết, giảm tiểu cầu + Rối loạn hệ miễn dịch Quá mẫn cảm + Rối loạn chuyển hóa và dinh dưỡng Nhiễm toan tăng clo máu, giảm ka-li máu, tăng thèm ăn, nhiễm toan chuyển hóa, khát nhiều + Rối loạn tâm thần Hành vi bất thường, không có khả năng đạt cực khoái, lãnh đạm, khóc, phân tán chú ý, rối loạn trong kích thích tình dục, khó phát âm, tỉnh giấc sớm, khí sắc phấn chấn, khí sắc phởn phơ, cảm xúc cùn mòn, ảo giáo, ảo thanh, ảo thị, hưng cảm nhẹ, mất ngủ đầu giấc, mất khả năng nói tự phát, giảm ham muốn tình dục, bơ phờ, mất ham muốn tình dục, hưng cảm, mất ngủ giữa giấc, giảm cảm giác cực khoái, cơn hoảng loạn, rối loạn hoảng sợ, phản ứng hoảng loạn, hoang tưởng, chứng lặp đi lặp lại, rối loạn đọc, bồn chồn, rối loạn giác ngủ, ý tưởng tự sát, có hành vi tự sát, dễ khóc, ý nghĩ khác thường + Rối loạn hệ thần kinh Mát vị giác, mất vận động, mất khứu giác, mất ngôn ngữ, mất dùng động tác, tiền triệu, cảm giác bỏng, hội chứng tiểu não, rối loạn nhịp thức ngủ trong ngày, vụng về, động kinh cục bộ phức tạp, co giật, suy giảm các mức độ ý thức, chóng mặt tư thế, chảy dãi, loạn cảm giác, rối loạn khả năng viết, loạn vận động, loạn ngôn ngữ, loạn trương lực cơ, run vô căn, cảm giác kiến bò, co giật cơn lớn, tăng cảm giác, ngủ nhiều, giảm vị giác, giảm vận động, giảm khứu giác, bệnh thần kinh ngoại vi, loạn khứu giác, chất lượng giấc ngủ kém, gần ngất, nhại lời, rối loạn cảm giác, mất cảm giác, sững sờ, ngất, không đáp ứng khi kích thích + Rối loạn mắt Rối loạn điều tiết, thay đổi năng lực nhìn sâu, nhược thị, co thắt mi, mù thoáng qua, mù 1 bên, tăng nhãn áp, tăng tiết nước mắt, giãn đồng tử, mù về đêm, hoa mắt, lão thị, điểm mù nhấp nháy, điểm mù, giảm tầm nhìn kịch phát + Rối loạn tai và tai trong Điếc, điếc thần kinh, điếc 1 bên, khó chịu ở tai, giảm sức nghe. + Rối loạn tim Nhịp tim chậm, nhịp chậm xoang, đánh trống ngực + Rối loạn mạch Đỏ bừng, nóng bừng, hạ huyết áp tư thế, hiện tượng Raynaud + Rối loạn trung thất, lồng ngực và hô hấp Khó phát âm, khó thở gắng sức, xung huyết mũi, tăng tiết dịch xoang cạnh mũi + Rối loạn hệ tiêu hóa Khó chịu ở bụng, đau bụng dưới, đau bụng âm ỉ, hơi thở có mùi, khó chịu thượng vị, đầy hơi, đau lưỡi, giảm cảm giác ở miệng, đau miệng, viêm tụy, tăng tiết nước bọt + Rối loạn da và mô dưới da Không tiết mồ hôi, viêm da dị ứng, ban đỏ, nổi mẩn, mất màu da, da có mùi bất thường, sưng mặt, mày đay, mày đay khu trú + Rối loạn cơ xương mô liên kết Đau hông, mỏi cơ, yếu cơ, cứng cơ xương + Rối loạn thận và hệ tiết niệu Sỏi niệu quản, tiểu ra sỏi, tiểu máu, không tự chủ, tiểu gấp, đau quặn thận, đau thận, tiểu không tự chủ. + Rối loạn hệ sinh sản và vú Rối loạn chức năng tình dục + Rối loạn toàn thân Đọng vôi, phù mặt, cảm giác bất thường, cảm giác say, cảm giác bồn chồn, khó ở, lạnh ngoại vi, uể oải + Các chỉ số khác Giảm bicarbonat máu, có tinh thể trong nước tiểu, bắt thường dáng đi khi đi nối bước, giảm số lượng bạch cầu |
Các dữ liệu lâm sàng khác - bệnh nhân nhi
Các phản ứng bất lợi được báo cáo ở những bệnh nhân nhi được điều trị với TOPAMAX có tỉ lệ < 2% ghi nhận trong các thử nghiệm lâm sàng mù đôi có đối chứng hoặc ở bất kỳ tỷ lệ nào trong các thử nghiệm lâm sàng nhãn mở được trình bày trong Bảng 7.
| Bảng 7. Các phản ứng bất lợi được báo cáo ở những bệnh nhân nhi được điều trị với TOPAMAX được ghi nhận < 2% trong thử nghiệm lâm sàng mù đôi có đối chứng hoặc ở bất kỳ tỷ lệ nào trong các thử nghiệm lâm sàng nhãn mở |
|
+ Rối loạn máu và hệ bạch huyết Tăng bạch cầu ái toan, giảm bạch cầu, bệnh hạch bạch huyết, giảm lượng tiểu cầu. + Rối loạn hệ thống miễn dịch Quá mẫn cảm + Rối loạn chuyển hóa và dinh dưỡng Nhiễm toan tăng clo máu, giảm kali máu, thèm ăn + Rối loạn tâm thần Giận dữ, lãnh đạm, khóc, phân tán chú ý, rối loạn ngôn ngữ diễn đạt, mất ngủ đầu giấc, mất ngủ, mất ngủ giữa giấc, khí sắc 2 chiều, chứng lặp đi lặp lại, rối loạn giấc ngủ, ý tưởng tự tử, có hành vi tự tử. + Rối loạn hệ thần kinh Rối loạn nhịp thức ngủ trong ngày, loạn vận ngôn, co giật, loạn vị giác, co giật cơn lớn, giảm cảm giác, sa sút tinh thần, rung giật nhãn cầu, loạn khứu giác, giấc ngủ kém chất lượng, tăng hoạt động tâm thần vận động, suy giảm kỹ năng tâm thần vận động, ngất, run. + Rối loạn về mắt Nhìn đôi, tăng tiết nước mắt, nhìn mờ Rối loạn về tai và ống tai trong Đau tai + Rối loạn tim Đánh trống ngực, nhịp chậm xoang + Rối loạn mạch Hạ huyết áp tư thế + Rối loạn hô hấp, lồng ngực và trung thất Xung huyết mũi, tăng tiết dịch xoang bên mũi, sổ mũi + Rối loạn hệ tiêu hóa Khó chịu ở bụng, đau bụng, khô miệng, đầy hơi, viêm dạ dày, bệnh trào ngược dạ dày-thực quản, chảy máu lợi, đau lưỡi, viêm tụy, dị cảm ở miệng, khó chịu ở dạ dày. + Rối loạn cơ-xương và mô liên kết Đau khớp, cứng cơ-xương, đau cơ. + Rối loạn thận và hệ tiết niệu Tiểu không tự chủ, tiểu gấp, đái dắt + Rối loạn toàn thân Tính tình bắt thường, chứng thân nhiệt cao, khó chịu, uể oải |
Dữ liệu hậu mãi
- Các phản ứng bất lợi được xác định là phản ứng bất lợi của thuốc của TOPAMAX sau khi đã lưu hành trên thị trường được trình bày trong Bảng 8, tần suất gặp được xếp theo quy ước sau: rất thường gặp ≥ 1/10, thường gặp ≥ 1/100 tới < 1/10, ít gặp ≥ 1/1,000 tới < 1/100, hiếm gặp ≥ 1/10,000 tới < 1/1,000, rất hiếm gặp < 1/10,000 bao gồm những báo cáo riêng lẻ.
Trong Bảng 8, phản ứng bất lợi được trình bày theo phân loại tần suất xảy ra dựa trên các tỷ lệ báo cáo tự phát.
Bảng 8. Các phản ứng bất lợi được nhận biết sau khi đã lưu hành trên thị trường với TOPAMAX theo loại tần suất xảy ra ước tính từ tỷ lệ của các báo cáo tự phát
| Hệ thống cơ quan | Rất thường gặp | Thường gặp | Ít gặp | Hiếm | Rất hiếm |
| Nhiễm trùng và nhiễm ký sinh trùng | Viêm mũi họng* | ||||
| Rối loạn máu và hệ bạch huyết | Giảm bạch cầu trung tính | ||||
| Rối loạn hệ thống miễn dịch | Phù nề do dị ứng Phù nề kết mạc |
||||
| Rối loạn chuyển hóa và dinh dưỡng | Tăng ammoniac huyết; bệnh não do tăng ammoniac huyết | ||||
| Rối loạn tâm thần | Cảm giác tuyệt vọng | ||||
| Rối loạn mắt | Dị cảm ở mắt; Tăng nhãn áp góc đóng; Rối loạn cử động mắt; Phù nề mí mắt; Bệnh lý vùng điểm vàng; Cận thị |
||||
| Rối loạn hô hấp, lồng ngực và trung thất | Ho | ||||
| Rối loạn da và mô dưới da | Ban đỏ đa dạng Phù nề quanh hốc mắt Hội chứng Steven-Johnson Hoại tử da nhiễm độc |
||||
| Rối loạn cơ xương và mô liên kết | Sưng khớp Khó chịu ở chi |
||||
| Rối loạn thận và hệ tiết niệu | Nhiễm toan ống thận | ||||
| Rối loạn toàn thân và tình trạng tại nơi dùng thuốc | Phù nề toàn thân Ốm dạng bệnh cúm |
||||
| Các chỉ số khác | Tăng cân |
* Viêm mũi họng theo dữ liệu thử nghiệm lâm sàng là do nhiễm trùng hoặc các nguyên nhân khác, và không được xem như là một phản ứng bất lợi.
Thông báo cho bác sĩ những tác dụng không mong muốn gặp phải khi dùng thuốc.
Tương tác với các thuốc khác
- (Đối với mục tiêu của phần này, liều không gây ảnh hưởng là liều không làm thay đổi quá 15%)
Tác động của TOPAMAX với các thuốc chống động kinh khác
- Việc phối hợp thêm TOPAMAX khi đang điều trị với các thuốc chống động kinh khác (phentoin, carbamazepin, acid valproic, phenobarbital, primidon) không ảnh hưởng đến nồng độ đạt trạng thái ổn định trong huyết tương của các thuốc này, ngoại trừ ở vài bệnh nhân, việc phối hợp thêm TOPAMAX khi đang điều trị với phenytoin có thể làm tăng nồng độ của phenytoin trong huyết tương. Điều này có thể là do sự ức chế của một enzym đặc hiệu dạng đồng phân đa hình (CYP2C19). Vì vậy, bất cứ người bệnh nào đang dùng phenytoin có những dấu hiệu hoặc triệu chứng lâm sàng của độc tính thuốc, thì nên kiểm tra nồng độ của phenytoin.
- Có một nghiên cứu về tương tác dược động học trên bệnh nhân động kinh đã cho thấy nếu đang dùng lamotrigin, khi thêm topiramat ở liều 100 - 400mg/ngày cũng không ảnh hưởng lên nồng độ lamotrigin ở trạng thái ổn định trong huyết tương. Hơn nữa, cũng không thấy thay đổi về nồng độ topiramat ở trạng thái ổn định trong huyết tương trong khi hoặc sau khi ngừng điều trị với lamotrigin (liều trung bình là 327mg/ngày).
Tác động của các thuốc chống động kinh khác trên TOPAMAX
- Phenytoin và carbamazepin làm giảm nồng độ huyết tương của TOPAMAX. Khi phối hợp thêm hoặc ngừng phenytoin hay carbamazepin trong khi đang điều trị với TOPAMAX có thể cần chỉnh liều dùng của TOPAMAX. Việc chỉnh liều này nên tiến hành dựa vào hiệu quả lâm sàng. Dùng thêm hoặc ngừng acid valproic không làm thay đổi đáng kể về mặt lâm sàng nồng độ trong huyết tương của TOPAMAX và do dó, không cần điều chỉnh liều dùng của TOPAMAX.
Các tương tác này được tóm tắt như sau:
| Dùng chung các thuốc chống động kinh khác | Nồng độ các thuốc chống động kinh khác | Nồng độ TOPAMAX |
| Phenytoin | ↔** | ↓ (48%) |
| Carbamazepin (CBZ) | ↔ | ↓ (40%) |
| Acid Valproic | ↔ | ↔ |
| Lamotrigin | ↔ | ↔ |
| Phenobarbital | ↔ | NS |
| Primidon | ↔ | NS |
↔ = Không ảnh hưởng trên nồng độ huyết tương (thay đổi ≤ 15%)
** = Nồng độ gia tăng tùy từng cá nhân
↓ = Nồng độ giảm
NS = Không có nghiên cứu
Các tương tác thuốc khác
Digoxin
- Trong nghiên cứu đơn liều, diện tích dưới đường cong (AUC) của nồng độ digoxin trong huyết thanh giảm 12% khi dùng đồng thời với TOPAMAX. Tương quan về mặt lâm sàng của quan sát này chưa được thiết lập. Khi TOPAMAX được phối hợp thêm vào hay ngừng dùng ở những người bệnh đang điều trị với digoxin, cần chú ý kiểm tra thường kỳ digoxin trong huyết thanh.
Các thuốc ức chế hệ thần kinh trung ương
- Việc dùng chung TOPAMAX với rượu hoặc các thuốc ức chế hệ thần kinh trung ương khác chưa được đánh giá trong các nghiên cứu lâm sàng, vì vậy khuyến cáo TOPAMAX không dùng chung với rượu hoặc các thuốc ức chế hệ thần kinh trung ương khác.
Các thuốc tránh thai đường uống
- Trong nghiên cứu tương tác dược động học ở những người tình nguyện khoẻ mạnh đang sử dụng đồng thời với các thuốc tránh thai đường uống dạng kết hợp chứa 1mg norethindron (NET) và 35mcg ethinyl estradiol (EE), TOPAMAX được sử dụng đơn thuần với liều 50 - 200mg/ngày không làm thay đổi đáng kể có ý nghĩa thống kê trong phơi nhiễm trung bình (AUC) của các thành phần có trong thuốc ngừa thai uống. Trong 1 nghiên cứu khác, phơi nhiễm với EE giảm có ý nghĩa thống kê ở liều 200, 400 và 800mg/ngày (tương ứng là 18%, 21% và 30%) khi sử dụng phối hợp ở những bệnh nhân đang uống acid valproic, ở cả 2 nghiên cứu, TOPAMAX (50mg/ngày đến 800mg/ngày) không ảnh hưởng đáng kể lên phơi nhiễm với NET. Mặc dù trong khoảng liều TOPAMAX từ 200 - 800mg/ngày, phơi nhiễm EE có sự suy giảm phụ thuộc liều, nhưng trong khoảng liều TOPAMAX từ 50 - 200mg/ngày, phơi nhiễm EE không bị thay đổi phụ thuộc liều đáng kể. Chưa quan sát thấy ý nghĩa lâm sàng của những thay đổi này. Khả năng làm giảm hiệu quả của thuốc tránh thai đường uống và tăng nguy cơ xuất huyết đột xuất nên được chú ý ở bệnh nhân đang dùng thuốc tránh thai đường uống đồng thời với TOPAMAX. Bệnh nhân đang dùng thuốc tránh thai có chứa estrogen nên được dặn dò về việc báo cáo bất kỳ sự thay đổi nào trong vấn đề xuất huyết của họ. Hiệu quả của thuốc tránh thai có thể giảm thậm chí khi không có xuất huyết.
Lithium
- Trên người tình nguyện khỏe mạnh, quan sát thấy có sự giảm phơi nhiễm hệ thống với lithium (18% diện tích dưới đường cong nồng độ huyết thanh - AUC), khi dùng cùng topiramat 200mg/ngày. Ở những bệnh nhân bị rối loạn lưỡng cực, dược động học của lithium không bị ảnh hưởng trong thời gian điều trị với topiramat 200mg/ngày; tuy nhiên, sau khi dùng topiramat tới mức 600mg/ngày thì có tăng phơi nhiễm hệ thống (26% AUC). Khi dùng chung với topiramat, cần phải theo dõi nồng độ lithium.
Risperidon
- Các nghiên cứu tương tác giữa thuốc - thuốc trên người tình nguyện khỏe mạnh và người bệnh bị rối loạn lưỡng cực, trong điều kiện dùng đơn liều, và đa liều, cho kết quả tương tự nhau. Khi dùng chung với topiramat, ở những liều topiramat tăng từng nấc là 100, 250 và 400mg/ngày, thì thấy có giảm phơi nhiễm hệ thống (16% và 33% AUC ở trạng thái hằng định, với các liều lần lượt là 250 và 400mg/ngày) của risperidon (liều từ 1 đến 6mg/ngày). Có thay đổi rất ít về dược động học của toàn bộ phần bán hoạt tính (risperidon và 9-hydroxyrisperidon), và không thay có thay đổi về dược động học của 9-hydroxyrisperidon. Không có thay đổi có ý nghĩa lâm sàng trong phơi nhiễm hệ thống của toàn bộ phần bán hoạt tính của risperidon, hay topiramat, do vậy tương tác thuốc giữa hai thuốc này không có ý nghĩa lâm sàng.
Hydrochlorothiazid (HCTZ)
- Một nghiên cứu về tương tác thuốc - thuốc ở trên người tình nguyện khỏe mạnh, nhằm đánh giá dược động học trong trạng thái ổn định của HCTZ (liều 25mg mỗi 24 giờ) và topiramat (96mg mỗi 12 giờ), khi dùng đơn độc, hay kết hợp với nhau. Kết quả nghiên cứu cho thấy Cmax của topiramat tăng 27% và AUC tăng 29% khi phối hợp thêm với HCTZ. Ý nghĩa lâm sàng của những thay đổi này chưa rõ. Điều trị phối hợp HCTZ với topiramat có thể cần phải chỉnh liều topiramat. Dược động học ở trạng thái ổn định của HCTZ không bị ảnh hưởng đáng kể bởi dùng đồng thời topiramat. Kết quả xét nghiệm lâm sàng cho thấy có giảm kali huyết thanh sau khi dùng topiramat hay HCTZ, mức giảm nhiều hơn khi hai thuốc này dùng cùng lúc với nhau.
Metformin
- Một nghiên cứu tương tác thuốc - thuốc được thực hiện ở người tình nguyện khỏe mạnh để đánh giá về dược động học trạng thái ổn định của metformin và topiramat trong huyết tương khi dùng metformin đơn độc hay dùng đồng thời metformin và topiramat. Kết quả của nghiên cứu cho thấy Cmax và AUC 0-12h trung bình của metformin tăng lần lượt là 18% và 25%, trong khi giá trị CL/F trung bình giảm 20% khi metformin đựợc dùng đồng thời với topiramat. Topiramat không ảnh hưởng lên tmax của metformin. Ý nghĩa lâm sàng của tác động của topiramat lên dược động học của metformin là chưa rõ.
- Sự thanh thải qua huyết tương khi uống topiramat giảm khi dùng kèm với metformin. Mức độ thay đổi của sự thanh thải thì không được biết rõ. Ý nghĩa lâm sàng của tác động của metformin đối với dược động học của topiramat thì không rõ. Khi TOPAMAX được dùng phối hợp hay ngừng ở bệnh nhân đang điều trị metformin, phải đặc biệt chú ý theo dõi thường xuyên để kiểm soát thích hợp tình trạng bệnh tiểu đường.
Pioglitazon
- Nghiên cứu tương tác thuốc - thuốc được thực hiện ở người tình nguyện khỏe mạnh để đánh giá dược động học ở trạng thái ổn định của pioglitazon và topiramat khi dùng đơn độc hay dùng đồng thời. Quan sát thấy giảm 15% AUCτ,ss của pioglitazon mà không thay đổi về Cmax,ss. Kết quả này không có ý nghĩa thống kê. Thêm vào đó, thấy có giảm 13% Cmax,ss và 16% AUCτ,ss của chất chuyển hóa hydroxy có hoạt tính, và giảm 60% Cmax,ss và AUCτ,ss của chất chuyển hóa keto có hoạt tính. Ý nghĩa lâm sàng của những phát hiện này không biết rõ. Khi đang điều trị pioglitazon mà thêm TOPAMAX, hay khi đang điều trị TOPAMAX mà thêm pioglitazon, thì phải chú ý theo dõi bệnh nhân thường xuyên để kiểm soát tình trạng bệnh tiểu đường một cách thích hợp.
Glyburid
- Nghiên cứu tương tác thuốc - thuốc được thực hiện ở bệnh nhân tiểu đường tuýp 2 để đánh giá về dược động học ở trạng thái ổn định của glyburid (5mg/ngày) dùng đơn độc hay dùng đồng thời với topiramat (150mg/ngày). Thấy có giảm 25% AUC24 của glyburid trong khi dùng topiramat. Phơi nhiễm hệ thống của các chất chuyển hóa có hoạt tính, 4-trans-hydroxy-glyburid (M1) và 3-cis-hydroxyglyburid (M2), cũng bị giảm lần lượt là 13% và 15%. Dược động học ở trạng thái ổn định của topiramat không bị ảnh hưởng khi dùng đồng thời với glyburid. Khi đang điều trị glyburid mà thêm topiramat, hay khi đang điều trị topiramat mà thêm glyburid, thì phải theo dõi chặt chẽ bệnh nhân đều đặn, nhằm kiểm soát tình trạng bệnh tiểu đường một cách thích hợp.
Lưu ý khi sử dụng (Cảnh báo và thận trọng)
Lái xe và vận hành máy móc
- TOPAMAX gây ảnh hưởng nhẹ hoặc trung bình lên khả năng lái xe và vận hành máy móc. TOPAMAX tác động trên hệ thần kinh trung ương, có thể gây buồn ngủ, chóng mặt hoặc các triệu chứng liên quan khác. Nó có thể gây ra các rối loạn thị giác và/hoặc nhìn mờ. Những tác dụng bất lợi này có thể gây nguy hiểm cho người bệnh khi lái xe hay vận hành máy móc, đặc biệt cho đến khi kinh nghiệm dùng thuốc trên từng bệnh nhân được thiết lập.
Phụ nữ mang thai và cho con bú
Phụ nữ có thai
- Topiramat gây quái thai ở chuột nhắt, chuột cống và thỏ. Ở chuột cống, topiramat qua được hàng rào nhau thai.
- Dữ liệu từ tổ chức kiểm soát thai sản của Anh và tổ chực kiểm soát thai sản có điều trị thuốc chống động kinh của Bắc Mỹ (NAAED) chỉ ra rằng trẻ sơ sinh khi đã phơi nhiễm với topiramat đơn trị liệu trong 3 tháng đầu thai kỳ có thể bị tăng nguy cơ dị tật bẩm sinh (ví dụ khuyết tật sọ và mặt như sứt môi/hở vòm miệng, dị tật lỗ tiểu thấp, và những bất thường liên quan đến các hệ thống khác của cơ thể). Dữ liệu từ tổ chức kiểm soát thai sản NAAED chỉ ra rằng tỷ lệ dị tật bẩm sinh của nhóm dùng topiramat đơn trị liệu cao gấp 3 lần nhóm không dùng thuốc chống động kinh. Hơn nữa, tỷ lệ trẻ sơ sinh nhẹ cân (< 2500g) trên nhóm điều trị bằng topiramat cũng cao hơn so với nhóm tham chiếu.
- Ngoài ra, dữ liệu từ các tổ chức này và từ các nghiên cứu khác đã chỉ ra rằng, có sự tăng nguv cơ quái thai liên quan đến việc sử dụng thuốc chống động kinh trong nhóm điều trị kết hợp so với nhóm đơn trị liệu.
- Khuyến cáo phụ nữ trong độ tuổi sinh sản nên sử dụng các biện pháp tránh thai phù hợp và lựa chọn các liệu pháp thay thế.
Phụ nữ cho con bú
- Nghiên cứu trên động vật đã chỉ ra rằng topiramat được bài tiết trong sữa. Sự bài tiết của topiramat vào trong sữa mẹ chưa được đánh giá ở những thử nghiệm có đối chứng, ở một số ít bệnh nhân cho thấy có sự tiết nhiều topiramat vào sữa mẹ. Vì nhiều thuốc được bài tiết qua sữa mẹ, nên cần quyết định là ngừng/tránh dùng topiramat hay ngừng cho con bú, tuỳ theo tầm quan trọng của thuốc đối với ngươi mẹ. (Xem mục Cảnh báo và Thận trọng).
Chỉ định động kinh
- Trong thời kỳ mang thai, topiramat nên được kê đơn sau khi thông báo đầy đủ cho người mẹ về nguy cơ của chứng động kinh không kiểm soát đối với phụ nữ mang thai và nguy cơ tiềm tàng với bào thai do thuốc.
Chỉ định dự phòng đau nửa đầu
- Topiramat chống chỉ định với phụ nữ có thai và phụ nữ trong độ tuổi sinh sản nếu không sử dụng các phương pháp tránh thai hiệu quả (Xem mục Chống chỉ định và Tương tác với các thuốc khác và các loại tương tác khác).
Bảo quản
- Ở nhiệt độ không quá 30°C. Bảo quản trong bao bì gốc.
- Không bảo quản thuốc lẫn với thức ăn.
- Để xa tầm nhìn và tầm tay trẻ em.
*** Vui lòng xem thông tin chi tiết Miễn trừ trách nhiễm
*** Hiệu quả của sản phẩm có thể thay đổi tùy theo cơ địa của mỗi người.
*** Sản phẩm này không phải là thuốc, không có tác dụng thay thế thuốc chữa bệnh.
*** ( Thực phẩm chức năng ) Thực phẩm bảo vệ sức khỏe giúp hỗ trợ nâng cao sức đề kháng, giảm nguy cơ mắc bệnh, không có tác dụng điều trị và không thể thay thế thuốc chữa bệnh.
If you foreigner you can contact through number: 0918 00 6928
or chat social:
*** Website chosithuoc.com không bán lẻ dược phẩm, mọi thông tin trên website nhằm cung cấp thông tin tham khảo sản phẩm. Website hoạt đồng dưới hình thức hợp đồng mua bán với các đối tác có đủ điều kiện kinh doanh Dược phẩm như: Bệnh viện, Nhà Thuốc,... Chúng tôi không hoạt động bán lẻ dược phẩm dưới bất kỳ hình thức nào trên Website.